Типы химических связей. энергия связи – это энергия, необходимая для разрыва химической связи
Билет №10.
1.Характеристики химической связи – энергия, длина, кратность, полярность.
Причина образования химической связи.
Химическая связь – совокупность взаимодействий атомов, приводящая к образованию устойчивых систем (молекул, комплексов, кристаллов.). Она возникает, если в результате перекрывания е облаков атомов происходит уменьшение полной энергии системы. Мерой прочности служит энергия связи, которая определяется работой, нужной для разрушения данной связи.
Виды хим. связи: ковалентная (полярная, неполярная, обменная и донорно-акцепторная), ионная, водородная и металлическая.
Длина связи – расстояние между центрами атомов в молекуле. Энергия и длина связей зависят от характера распределения Эл. плотности между атомами. На распределение е плотности влияет пространственная направленность хим. связи. Если 2-х атомные молекулы всегда линейны, то формы многоатомных молекул м.б. различны.
Угол между воображаемыми линиями, которые можно провести через центры связанных атомов называется валентным. Распределение е плотности так же зависит от размеров ат. и их эо. В гомоатомных Эл. плотность распределена равномерно. В гетероатомных смещена в том направлении, которое способствует уменьшению энергии системы.
Энергия связи – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Энергия связи отличается от ΔHобр. Теплота образования – это энергия, которая выделяется или поглощается при образовании молекул из простых веществ. Так:
N2 + O2 → 2NO + 677,8 кДж/моль – ∆Hобр.
N + O → NO - 89,96 кДж/моль – Е св.
Кратность связи определяется количеством электронных пар, участвующих в связи между атомами. Химическая связь обусловлена перекрыванием электронных облаков. Если это перекрывание происходит вдоль линии, соединяющей ядра атомов, то такая связь называется σ-связью. Она может быть образована за счет s – s электронов, р – р электронов, s – р электронов. Химическая связь, осуществляемая одной электронной парой, называется одинарной.
Если связь образуется более чем одной парой электронов, то она называется кратной.
Кратная связь образуется в тех случаях, когда имеется слишком мало электронов и связывающихся атомов, чтобы каждая пригодная для образования связи валентная орбиталь центрального атома могла перекрыться с какой-либо орбиталью окружающего атома.
Поскольку р-орбитали строго ориентированы в пространстве, то они могут перекрываться только в том случае, если перпендикулярные межъядерной оси р-орбитали каждого атома будут параллельны друг другу. Это означает, что в молекулах с кратной связью отсутствует вращение вокруг связи.
Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, Cl2 и т. п., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов. В подобном случае ковалентная связь называется неполярной или гомеополярной. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таких случаях ковалентная связь называется полярной или гетерополярной.
Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются величиной относительной электроотрицательности. Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару. Иначе говоря, при образовании ковалентной связи между двумя атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше различаются электроотрицательности взаимодействующих атомов. Значения электроотрицательности атомов некоторых элементов по отношению к электроотрицательности фтора, которая принята равной 4.
Электроотрицательность закономерно изменяется в зависимости от положения элемента в периодической системе. В начале каждого периода находятся элементы с наиболее низкой электроотрицательностью - типичные металлы, в конце периода (перед благородными газами) - элементы с наивысшей электроотрицательностью, т. е. типичные неметаллы.
У элементов одной и той же подгруппы электроотрицательность с ростом заряда ядра проявляет тенденцию к уменьшению. Таким образом, чем более типичным металлом является элемент, тем ниже его электроотрицательность; чем более типичным неметаллом является элемент, тем выше его электроотрицательность.
Причина образования химической связи. Атомы большинства химических элементов в индивидуальном виде не существует, так как взаимодействуют между собой, образуя сложные частицы (молекулы, ионы и радикалы). Между атомами действуют электоростатические силы, т.е. сила взаимодействия электрических зарядов, носителями которых являются электроны и ядра атомов. В образовании химической связи между атомами главную роль играют валентные электроны.
Причины образования химической связи между атомами можно искать в электростатической природе самого атома. Благодаря наличию в атомах пространственно разделенных областей, обладающих электрическим зарядом, между различными атомами могут возникать электростатические взаимодействия, способные удерживать эти атомы вместе.
При образовании химической связи происходит перераспределение в пространстве электронных плотностей, исходно относившихся к различным атомам. Поскольку наименее прочно связаны с ядром электроны внешнего уровня, то в образовании химической связи именно этим электронам принадлежит главная роль. Количество химических связей, образованных данным атомом в соединении, называют валентностью. По этой причине электроны внешнего уровня называют валентными электронами.
2.Характеристики химической связи - энергия, длина, кратность, полярность.
Энергия связи – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Энергия связи отличается от ΔHобр. Теплота образования – это энергия, которая выделяется или поглощается при образовании молекул из простых веществ.(Энергии связей в молекулах, состоящих из одинаковых атомов, уменьшаются по группам сверху вниз)
Для двухатомных молекул энергия связей равна энергии диссоциации, взятой с обратным знаком: например в молекуле F2 энергия связи между атомами F-F равна - 150,6 кДж/моль. Для многоатомных молекул с одним типом связи, например, для молекул АВn, средняя энергия связи равна 1/n части полной энергии образования соединения из атомов. Так, энергия образования СН4 = -1661,1 кДж/моль.
Если в молекуле соединяются более двух различных атомов, то средняя энергия связи не совпадает с величиной энергии диссоциации молекулы. Если в молекуле представлены различные типы связи, то каждому из них можно приближенно приписать определенное значение Е. Это позволяет оценить энергию образования молекулы из атомов. Например, энергию образования молекулы пентана из атомов углерода и водорода можно вычислить по уравнению:
Е = 4EC-C + 12EC-H.
Длина связи – это расстояние между ядрами взаимодействующих атомов. Ориентировочно оценить длину связи можно, исходя из атомных или ионных радиусов, или из результатов определения размеров молекул с помощью числа Авогадро. Так, объем, приходящийся на одну молекулу воды: , о
Чем выше порядок связи между атомами, тем она короче.
Кратность: Кратность связи определяется количеством электронных пар, участвующих в связи между атомами. Химическая связь обусловлена перекрыванием электронных облаков. Если это перекрывание происходит вдоль линии, соединяющей ядра атомов, то такая связь называется σ-связью. Она может быть образована за счет s – s электронов, р – р электронов, s – р электронов. Химическая связь, осуществляемая одной электронной парой, называется одинарной.
Если связь образуется более чем одной парой электронов, то она называется кратной.
Кратная связь образуется в тех случаях, когда имеется слишком мало электронов и связывающихся атомов, чтобы каждая пригодная для образования связи валентная орбиталь центрального атома могла перекрыться с какой-либо орбиталью окружающего атома.
Поскольку р-орбитали строго ориентированы в пространстве, то они могут перекрываться только в том случае, если перпендикулярные межъядерной оси р-орбитали каждого атома будут параллельны друг другу. Это означает, что в молекулах с кратной связью отсутствует вращение вокруг связи.
Полярность: Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, Cl2 и т. п., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов. В подобном случае ковалентная связь называется неполярной или гомеополярной. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таких случаях ковалентная связь называется полярной или гетерополярной.
Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются величиной относительной электроотрицательности. Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару. Иначе говоря, при образовании ковалентной связи между двумя атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше различаются электроотрицательности взаимодействующих атомов.
Смещение общего электронного облака при образовании полярной ковалентной связи приводит к тому, что средняя плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже - вблизи менее электроотрицательного. В результате первый атом приобретает избыточный отрицательный, а второй - избыточный положительный заряд; эти заряды принято называть эффективными зарядами атомов в молекуле.
3.Причина образования химической связи - является стремление атомов металлов и неметаллов путём взаимодействия с другими атомами достичь более устойчивой электронной структуры, подобной структуре инертных газов. Различают три основных вида связи: ковалентную полярную, ковалентную неполярную и ионную.
Ковалентная связь называется неполярной, если общая электронная пара в равной степени принадлежит обоим атомам. Ковалентная неполярная связь возникает между атомами, электроотрицательности которых одинаковы (между атомами одного и того же неметалла),т.е. в простых веществах. Например, в молекулах кислорода, азота, хлора, брома связь ковалентная неполярная.
Ковалентная связь называется полярной, если общая электронная пара смещена к одному из элементов. Ковалентная полярная связь возникает между атомами, электроотрицательности которых отличаются, но не сильно, т.е. в сложных веществах между атомами неметаллов. Например, в молекулах воды, хлороводорода, аммиака, серной кислоты связь ковалентная полярная.
Ионная связь – это связь между ионами, осуществляется за счёт притяжения разноимённо заряженных ионов. Ионная связь возникает между атомами типичных металлов (главная подгруппа первой и второй группы) и атомами типичных неметаллов (главная подгруппа седьмой группы и кислород).
4. Химическое равновесие. Константа равновесия. Расчёт равновесных концентраций.
Химическое равновесие - состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
А2 + В2 ⇄ 2AB
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Конста́нта равнове́сия - величина, определяющая для данной химической реакции соотношение между исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Способы выражения константы равновесия:
Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давления компонентов pi по формуле:
где νi - стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов - положительным). Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры.
Например, для реакции окисления монооксида углерода:
2CO + O2 = 2CO2
Константа равновесия может быть рассчитана по уравнению:
![]()
Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид:
Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:
В некоторых случаях (в зависимости от способа выражения) константа равновесия может являться функцией не только температуры, но и давления. Так, для реакции в смеси идеальных газов парциальное давление компонента может быть выражено по закону Дальтона через суммарное давление и мольную долю компонента (), тогда легко показать, что:
![]()
где Δn - изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ (Δn = 0), то Kp = Kx.
Сравнение данных по количеству электронов на внешней оболочке с количеством химических связей, которые может образовать данный атом, показало, что основы образования химической связи, выявленные при изучении молекулы водорода, действительны и для других атомов. Это происходит потому, что связь имеет электрическую природу и образуется за счет двух электронов (по одному от каждого атома). Поэтому следует ожидать корреляции между первой энергией ионизации (ПЭИ) атомов (имеющей электростатическое происхождение) и энергией их связи в двухатомных молекулах.
Экспериментальные данные по определению энергии связи для ряда двухатомных молекул (в газовой фазе), образованных из атомов 2-го и 3-го периодов, приведены в таблице 4.2 и на рис. 4.2.1.
Таблица 4.2
|
Молекула A 2 |
Энергия связи (кДж/моль) |
Молекула |
Энергия связи (кДж/моль) |
||
Рис. 4.2-1 Энергия связи в молекулах из элементов второго и третьего периодов в зависимости от ПЭИ элемента
Эти данные (см. в таблице 4.2, рис. 4.2-1) показывают, что энергия связи между атомами практически не зависит от ПЭИ связываемых атомов.
Неужели в двухатомных молекулах (где больше, чем один электрон) связь образуется по другому механизму и существуют дополнительные силы, ранее не учитываемые нами?
Прежде чем перейти к выявлению этих сил, попробуем объяснить эту независимость
на основе уже существующих взаимодействий.
Начнем с изучения дополнительных факторов, которые объясняют отсутствие ожидаемой корреляции и независимость
экспериментальных данных по измерению ПЭИ от энергии связи в двухатомных молекулах.
Разобьем таблицу (4.2) на четыре группы:
Группа А включает в себя молекулы, состоящие из идентичных атомов, у которых энергия связи ниже 40 кДж/моль. В газовой фазе эти молекулы распадаются на атомы.
Группа В включает в себя двухатомные молекулы, состоящие из идентичных атомов, энергия связи в которых колеблется от 400 кДж/моль до 1000 кДж/моль. Действительно, энергия связи в этих молекулах значительно отличается в большую сторону по сравнению с энергией связи в молекуле водорода, которая составляет 429 кДж/моль.
Группа С включает в себя двухатомные молекулы, состоящие из разных атомов, энергия связи в которых варьирует от 340 кДж/моль до 550 кДж/моль.
Группа D включает в себя двухатомные молекулы с идентичными атомами, энергия связи в которых составляет 50-350 кДж/моль.
ТАБЛИЦА
4.4
ЭНЕРГИЯ СВЯЗИ
В МОЛЕКУЛАХ
|
группа А |
группа В |
||
| молекула | энергия связи | молекула | энергия связи |
| Be 2 | 30 | C 2 | 602 |
| Ne 2 | 4 | N 2 | 941 |
| 7.6 | O 2 | 493 | |
| Ar 2 | 7 | P 2 | 477 |
| S 2 | 421 | ||
|
группа С |
группа D |
||
| молекула | энергия | молекула | энергия |
| LiF | 572 | B 2 | 274 |
| NaF | 447 | Br 2 | 190 |
| LiCl | 480 | Cl 2 | 239 |
| NaCl | 439 | F 2 | 139 |
| Li 2 | 110 | ||
| Na 2 | 72 | ||
Прежде, чем мы начнем объяснение, давайте уточним вопросы, которые мы должны охватить.
Первый
вопрос:
Почему энергия связи между многоэлектронными атомами гораздо меньше или гораздо больше (таблица 4.2), чем в молекуле водорода (H 2)?
Чтобы объяснить значительное отклонение энергии связи в многоатомных молекулах от энергии связи в молекуле водорода, необходимо углубить наше понимание причины, почему количество электронов на внешней оболочке ограничено.
Присоединение электрона к атому происходит, когда имеется выигрыш в энергии, или, другими словами, если абсолютное
значение потенциальной энергии системы атом + электрон
возрастает в результате связи электрона с атомом. Данные о сродстве атома к электрону, указанные в таблице 4.3, дают нам численное значение выигрыша в энергии при присоединения электрона к атому.
Таблица 4.3
|
Сродство |
|
Сродство |
При присоединении электрона к атому общая энергия притяжения электронов к ядру увеличивается из-за увеличения количества электронов, притягиваемых к ядру. С другой стороны, энергия межэлектронного отталкивания растет за счет увеличения количества электронов. То есть, присоединение электрона к атому происходит, если в результате этой связи, выигрыш в энергии притяжения больше, чем потеря энергии из-за увеличения энергии отталкивания.
Подсчет изменения энергии при присоединении электрона к атому водорода дает выигрыш в энергии в 3,4 эВ. Т.е., атом водорода должен иметь положительное сродство к электрону. Это и наблюдается в эксперименте.
Аналогичный расчет изменения потенциальной энергии при присоединении электрона к атому гелия показывает, что присоединение электрона приводит не к увеличению потенциальной энергии, а к ее снижению. И действительно, сродство атома гелия, в соответствии с экспериментом, меньше нуля.
Поэтому, возможность присоединять или не присоединять электрон к атому определяется различиями в изменении абсолютных значений потенциальной энергии притяжения всех электронов к ядру и взаимного межэлектронного отталкивания. Если эта разница больше нуля, то электрон присоединится, а если меньше нуля, то нет.
Данные о сродстве атомов к электрону приведенные в таблице 4.3, показывают, что для атомов 1-го, 2-го и 3-го периодов кроме Be,
Mg,
Ne,
Ar
увеличение энергии притяжения во время присоединения электронов к ядру больше, чем увеличение энергии отталкивания.
В случае с атомами Be,
Mg,
Ne,
Ar,
увеличение энергии притяжения во время присоединения электронов к ядру ниже, чем увеличение энергии межэлектронного отталкивания. Независимым подтверждением этого вывода является информация по ПЭИ для атомов 2-го и 3-го периодов, приведенная в таблице 4.2 (группа A).
При образовании химической связи, количество электронов на внешних электронных оболочках атомов увеличивается на один электрон, и согласно расчету модели молекулы водорода Н 2, эффективные заряды связываемых атомов изменяются. Эффективные заряды связываемых ядер изменяются из-за притяжения заряженных ядер, и в связи с увеличением количества электронов на внешних оболочках связываемых атомов.
В молекуле водорода сближение ядер приводит к увеличению силы притяжения связывающих электронов к ядрам на 50%, что равно увеличению эффективного заряда связываемых ядер на 0,5 протонных единицы (см.главу 3).
С точки зрения выигрыша в энергии, образование связи - это нечто вроде промежуточного процесса между присоединением электрона к нейтральному атому (измеренное сродство к электрону) и присоединением электрона к атому, заряд ядра которого увеличивается на 1 единицу.
Согласно данным таблицы 4.3, при переходе от лития (ПЭИ - 519 кДж/моль) к бериллию (ПЭИ - 900 кДж/моль), ПЭИ увеличивается на 400 кДж/моль, а при переходе от бериллия к бору (ПЭИ - 799 кДж/моль) выигрыш в энергии снижается до 100 кДж/моль.
Вспомним, что внешней электронной оболочке бора имеется 3 электрона, а на внешней оболочке бериллия находятся 2 электрона. То есть, когда электрон присоединяется к бериллию с одновременным увеличением заряда ядра на одну протонную единицу, связываемый электрон входит во внешнюю оболочку бериллия, при этом выигрыш в энергии будет на 100 кДж/моль меньше, чем при вхождении электрона во внешнюю оболочку лития (при переходе от лития к бериллию).
Теперь вполне понятно резкое уменьшение энергии связи у атомов с отрицательным сродством атома к электрону, указанное в таблице 4.3. Однако, хоть Ne, Be, Mg, Ar не присоединяют электроны, они создают молекулы, т.к. увеличивается эффективный заряд ядер. Энергия связи в этих молекулах (группа А ) значительно ниже, чем в остальных молекулах.
Теперь давайте ответим на второй вопрос: Почему энергия связи в двухатомных молекулах группы В, показанных в таблице 4.2. в 1,5-2 раза больше, чем энергия связи в молекуле водорода?
На внешних оболочках атомов углерода (C), азота (N) и кислорода (O) находятся, соответственно, 4, 5 и 6 электронов. Количество связей, которые образуют эти атомы, ограничивается количеством дополнительных электронов, которые могут войти во внешнюю оболочку при образовании связи. Таким образом, атомы углерода (C), азота (N) и кислорода (O ) могут образовать, соответственно, 4, 3 и 2 химические связи. Соответственно между двумя атомами, приведенными в таблице 4.4, может образоваться не одна, а несколько химических связей, что предполагает гораздо больший выигрыш в энергии, по сравнению с образованием 1 связи у двухатомной молекулы, где связываемые атомы имеют по 1 электрону во внешней оболочке
Если атомы связаны одной химической связью, то такая связь называется единичной химической связью или общей химической связью. Когда атомы связаны несколькими химическими связями (двойными или тройными), такие связи называются кратными связями . Кратные связи, например, у молекул азота (N 2) и кислорода (O 2) описываются структурными формулами: N ≡ N и O = O.
Теперь рассмотрим группу С : Почему энергия связи в некоторых из двухатомных молекул, состоящих из различных атомов, значительно больше, чем у других молекул, которые состоят из одинаковых атомов?
Разберем молекулу NaCl . Атомы натрия и хлора сильно отличаются по сродству к электрону. Представляем образование связи как двухстадийный процесс. На первой стадии выигрыш в энергии получается за счет сродства атомов к электронам. То есть, с этой точки зрения, выигрыш в энергии, при формировании молекулы Cl 2 , должен быть больше, чем при формировании молекулы NaCl на величину разницы их сродства к электрону.
При расчете молекулы водорода (глава 3) энергия связи (энергия, необходимая для того, чтобы разделить молекулы на атомы) представляла собой сумму двух составляющих:
разница между электронной энергией молекулы водорода и двух атомов водорода;
дополнительная энергия, расходуемая на нагрев неразделенных молекул.
Рассчитывая первый компонент, мы вычисляем энергию молекулы, которая равна разнице между энергией притяжения ядер атомов водорода к связывающей паре электронов и суммой энергии отталкивания межэлектронных и межъядерных сил.
Для оценки энергии притяжения ядер к связывающим парам электронов, а также для оценки энергии межэлектронного отталкивания, мы должны сначала узнать значение эффективного заряда связываемых ядер.
Потенциал ионизации и энергия связи в двухатомных молекулах
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
Энергия связи – это энергия, необходимая для разрыва химической связи. Энергии разрыва и образовании связи равны по величине но противоположны по знаку. Чем больше энергия химической связи, тем устойчивее молекула. Обычно энергию связи измеряют в кДж/моль.
Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Так, на разрыв связи H–H затрачивается 432,1 кДж/моль, а на разрыв четырех связей в молекуле метана CH 4 – 1648 кДж/∙моль и в этом случае E C–H = 1648: 4 = 412 кДж/моль.
Длина связи – это расстоянию между ядрами взаимодействующих атомов в молекуле. Она зависит от размеров электронных оболочек и степени их перекрывания.
Полярность связи – это распределение электрического заряда между атомами в молекуле.
Если электроотрицательности атомов, участвовавших в образовании связи одинаковы, то связь будет неполярная, а в случае разных электроотрицательностей – полярной. Крайний случай полярной связи, когда общая электронная пара практически полностью смещена к более электроотрицательному элементу, приводит к ионной связи.
Например: Н–Н – неполярная, Н–Сl – полярная и Nа + –Сl - – ионная.
Следует различать полярности отдельных связей и полярность молекулы в целом.
Полярность молекулы – это векторная сумма дипольных моментов всех связей молекулы.
Например:
1) Линейная молекула CO 2 (О=С=О) неполярна –дипольные моменты полярных связей С=О компенсируют друг друга.
2)Молекула воды полярна – дипольные моменты двух связей О-Н не компенсируют друг друга.
Пространственное строение молекул определяется формой и расположением в пространстве электронных облаков.
Порядок связи – это число химических связей между двумя атомами.
Например, порядок связи в молекулах H 2 , O 2 и N 2 равен соответственно 1, 2 и 3, поскольку связь в этих случаях образуется за счёт перекрывания одной, двух и трех пар электронных облаков.
4.1. Ковалентная связь – это связь между двумя атомами посредством общей электронной пары.
Количество химических связей определяется валентностями элементов.
Валентность элемента – число орбиталей, принимающих участие в образовании связей.
Ковалентная неполярная связь - эта связь, осуществляемая за счет образования электронных пар между атомами с равной электроотрицательностью. Например, Н 2 , О 2 , N 2 , Cl 2 и т. д.
Ковалентная полярная связь – эта связь между атомами с различной электроотрицательностью.
Например, НCl, H 2 S, PH 3 и т.д.
Ковалентная связь обладает свойствами:
1) Насыщаемости – способностью атома образовывать столько связей, сколько у него имеется валентностей.
2) Направленности – перекрытие электронных облаков происходит в направлении обеспечивающем максимальную плотность перекрытия.
4.2. Ионная связь – это связь между противоположно заряженными ионами.
Это крайний случай ковалентной полярной связи и возникает при большой разнице в электроотрицательностях взаимодействующих атомов. Иoннaя связь не обладает направленностью и насыщаемостью.
Степень окисления – это условный заряд атома в соединении исходя из предположения, что происходит полная ионизация связей.
Энергия связи является важным понятием в химии. Она определяет количество энергии, которое необходимо для разрыва ковалентной связи между двумя атомами газа. Данное понятие неприменимо по отношению к ионным связям. Когда два атома соединяются в молекулу, можно определить, насколько крепка связь между ними - достаточно найти энергию, которую необходимо затратить для разрыва этой связи. Помните, что единичный атом не обладает энергией связи, эта энергия характеризует силу связи двух атомов в молекуле. Чтобы рассчитать энергию связи для какой-либо химической реакции, просто определите общее количество разорванных связей и вычтите из него количество образовавшихся связей.
Шаги
Часть 1
Определите разорванные и образовавшиеся связи- Разрывы одинарной, двойной и тройной химической связи рассматриваются как одна разорванная связь. Хотя эти связи обладают разными энергиями, в каждом случае считается, что разрывается одна связь.
- То же самое относится и к образованию одинарной, двойной или тройной связи. Каждый такой случай рассматривается как формирование одной новой связи.
- В нашем примере все связи являются одинарными.
-
Определите, какие связи разрываются в левой части уравнения. Левая часть химического уравнения содержит реагирующие вещества, и в ней представлены все связи, которые разрываются в результате реакции. Это эндотермический процесс, то есть для разрыва химических связей необходимо затратить определенную энергию.
- К нашем примере левая часть уравнения реакции содержит одну связь H-H и одну связь Br-Br.
-
Подсчитайте количество образовавшихся связей в правой части уравнения. Справа указаны продукты реакции. В этой части уравнения представлены все связи, которые образуются в результате химической реакции. Это экзотермический процесс, и он протекает с выделением энергии (обычно в виде тепла).
- В нашем примере в правой части уравнения содержатся две связи H-Br.
Часть 2
Рассчитайте энергию связи-
Найдите необходимые значения энергии связи. Есть множество таблиц, в которых приведены значения энергии связи для самых разных соединений. Такие таблицы можно найти в интернете или справочнике по химии. Следует помнить, что значения энергии связи всегда приводятся для молекул в газообразном состоянии.
-
Умножьте значения энергии связи на число разорванных связей. В ряде реакций одна связь может разрываться несколько раз. Например, если молекула состоит из 4 атомов водорода, то энергию связи водорода следует учесть 4 раза, то есть умножить на 4.
- В нашем примере каждая молекула имеет по одной связи, поэтому значения энергии связи просто умножаются на 1.
- H-H = 436 x 1 = 436 кДж/моль
- Br-Br = 193 x 1 = 193 кДж/моль
-
Сложите все энергии разорванных связей. После того как вы умножите значения энергий связи на соответствующее количество связей в левой части уравнения, необходимо найти общую сумму.
- Найдем суммарную энергию разорванных связей для нашего примера: H-H + Br-Br = 436 + 193 = 629 кДж/моль.
Запишите уравнение для вычисления энергии связи. Согласно определению, энергия связи представляет собой сумму разорванных связей за вычетом суммы сформированных связей: ΔH = ∑H (разорванные связи) - ∑H (образовавшиеся связи) . ΔH обозначает изменение энергии связи, которое называют также энтальпией связи, а ∑H соответствует сумме энергий связи для обеих частей уравнения химической реакции.
Запишите химическое уравнение и обозначьте все связи между отдельными элементами. Если дано уравнение реакции в виде химических символов и цифр, полезно переписать его и обозначить все связи между атомами. Такая наглядная запись позволит вам легко посчитать связи, которые разрываются и образуются в ходе данной реакции.
Изучите правила подсчета разорванных и образовавшихся связей. В большинстве случаев при расчетах используются средние значения энергии связи. Одна и та же связь может иметь немного разную энергию, в зависимости от конкретной молекулы, поэтому обычно используют средние значения энергии связи. .
Энергия связи – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Энергия связи - это энергия, которая поглощается при удалении двух атомов на бесконечно большое расстояние друг от друга. А энтальпия образования - это теплота, которая выделяется при получении вещества из простых веществ, то есть, если говорить на языке энергий связи, сначала атомы простых веществ разносятся на бесконечно большое расстояние (с поглощением энергии), потом соединяются с образованием нужного вещества (выделяется энергия). Разность - энтальпия образования.
Энергия связи отличается от ΔH обр. Теплота образования – это энергия, которая выделяется или поглощается при образовании молекул из простых веществ. Так:
N 2 + O 2 → 2NO + 677,8 кДж/моль – ∆H обр.
N + O → NO - 89,96 кДж/моль – Е св.
Для двухатомных молекул энергия связей равна энергии диссоциации, взятой с обратным знаком: например в молекуле F 2 энергия связи между атомами F-F равна - 150,6 кДж/моль.
Для многоатомных молекул с одним типом связи, например, для молекул АВ n , средняя энергия связи равна 1/n части полной энергии образования соединения из атомов. Так, энергия образования СН 4 = -1661,1 кДж/моль. Так как в молекуле СН 4 четыре связи, то энергия одной связи С – Н равна 415,3 кДж/моль. Исследование большого числа известных в настоящее время данных по энергиям связи показывает, что энергия связи между конкретной парой атомов часто оказывается величиной постоянной при условии, что остальная часть молекулы изменяется незначительно. Так, в насыщенных углеводородах Е св (C – Н) = 415,3 кДж/моль, Е св (C – С) = 331,8 кДж/моль.
Энергии связей в молекулах, состоящих из одинаковых атомов, уменьшаются по группам сверху вниз По периоду энергии связей растут. В этом же направлении возрастает и сродство к электрону
В прошлом параграфе мы привели пример вычисления теплового эффекта реакции:
С(тв) + 2 H 2 (г) = CH 4 (г) + 76 кДж/моль.
В данном случае 76 кДж - это не просто тепловой эффект данной химической реакции, но еще и теплота образования метана из элементов .
ЭНТАЛЬПИЯ - это тепловой эффект реакции, измеренный (или вычисленный) для случая, когда реакция происходит в открытом сосуде (т.е. при неизменном давлении). Обозначается как ΔH.
Когда объем, занимаемый продуктами реакции, отличается от объема, занимаемого реагентами, химическая система может совершить дополнительную работу PΔV (где P - давление, а ΔV - изменение объема). Поэтому ΔН и ΔЕ связаны между собой соотношением:
ΔН = ΔЕ + PΔV
Итак, если реакция проводится не в "бомбе", то ЭНТАЛЬПИЯ и ТЕПЛОВОЙ ЭФФЕКТ совпадают между собой. Энтальпию называют также "теплосодержанием". Если мы проводим реакцию получения воды в открытом сосуде, то 286 кДж/моль - это "тепло" ΔН, содержащееся в водороде и кислороде для случая, когда мы получаем из них воду. Поскольку исходные вещества (водород и кислород) находились в нашем опыте в стандартных условиях (25 о С и давлении 1 атм), а продукт реакции (воду) мы тоже привели к стандартным условиям, мы вправе сказать, что 286 кДж/моль - это СТАНДАРТНАЯ ТЕПЛОТА ОБРАЗОВАНИЯ ВОДЫ или, что то же - СТАНДАРТНАЯ ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ВОДЫ. Если мы будем получать из тех же элементов не воду, а перекись водорода H 2 O 2 , то "теплосодержание" такой химической системы будет иным (187,6 кДж/моль). Во время протекания реакций с образованием 1 моля воды или 1 моля H 2 O 2 освобождается разное количество энергии, чего и следовало ожидать. В дальнейшем стандартную теплоту образования веществ мы чаще будем называть именно стандартной энтальпией образования ΔН . Чтобы подчеркнуть справедливость этой величины только длястандартных условий, в таблицах её обозначают следующим образом: ΔН о 298
Маленький "нолик" рядом с ΔН по традиции символизирует некое стандартное состояние, а цифра 298 напоминает, что значения приведены для веществ при 25 о С (или 298 К). Стандартная энтальпия не обязательно должна быть энтальпией образования вещества из элементов . Можно получить значение стандартной энтальпии ΔН о 298 для любой химической реакции. Но в нашем случае с получением воды из водорода и кислорода мы получили именно стандартную энтальпию образования воды. Записывается это так: H 2 + 0,5 O 2 = H 2 O (ΔН о 298 = -286 кДж/моль)
Откуда взялся знак "минус" перед значением теплового эффекта? Здесь автор со вздохом должен сообщить читателю о еще одной особенности представления теплоты (и энтальпии) в термодинамике. Здесь принято потерянную любой системой энергию представлять со знаком "минус" . Рассмотрим, например, уже знакомую нам систему из молекул метана и кислорода. В результате экзотермической реакции между ними происходит выделение теплоты: СH 4 (г) + 2 O 2 (г) = СO 2 (г) + 2 H 2 О(ж) + 890 кДж
Можно записать эту реакцию и другим уравнением, где выделившаяся ("потерянная") теплота имеет знак "минус": СH 4 (г) + 2 O 2 (г) – 890 кДж = СO 2 (г) + 2 H 2 О(ж)
По традиции энтальпию этой и других экзотермических реакций в термодинамике принято записывать со знаком "минус" : ΔН о 298 = –890 кДж/моль (энергия выделяется).
Наоборот, если в результате эндотермической реакции система поглотила энергию, то энтальпия такой эндотермической реакции записывается со знаком "плюс" . Например, для уже знакомой нам реакции получения CO и водорода из угля и воды (при нагревании): C(тв) + H 2 О(г) + 131,3 кДж = CO(г) + H 2 (г)
(ΔН о 298 = +131,3 кДж/моль)
К этой особенности термодинамического языка следует просто привыкнуть, хотя на первых порах путаница со знаками может изрядно досаждать при решении задач.
Давайте попробуем решить одну и ту же задачу сначала в термодинамической шкале (где выделяемая реакцией теплота имеет знак "минус"), а потом в термохимической шкале (которой мы пользовались в предыдущем параграфе и где выделяемая реакцией энергия имеет знак "плюс").
Итак, приведем пример расчета теплового эффекта реакции: Fe 2 O 3 (тв) + 3 C(графит) = 2 Fe(тв) + 3 CO(г)
Эта реакция происходит в доменной печи при очень высокой температуре (около 1500 о С). В справочниках, где используется термодинамическая шкала, можно найти стандартные теплоты образования Fe 2 O 3 (ΔН о 298 = –822,1 кДж/моль) и СО (ΔН о 298 = – 110,5 кДж/моль). Два других вещества из этого уравнения - углерод и железо - являются элементами, то есть их теплота образования по определению равна нулю. Поэтому стандартная теплота рассматриваемой реакции равна:
ΔН о 298 = 3× (-110,5) - (-822,1) = -331,5 + 822,1 = +490,6 кДж
Итак, реакция восстановления оксида железа (III) углерода является эндотермической (ΔН о 298 положительна!), причем на восстановление одного моля Fe 2 O 3 тремя молями углерода надо было бы затратить 490,6 кДж, если исходные вещества до начала реакции и продукты после окончания реакции находятся в стандартных условиях (то есть при комнатной температуре и атмосферном давлении). Не имеет значения, что исходные вещества пришлось сильно нагреть для того, чтобы реакция произошла. ВеличинаΔН о 298 = +490,6 кДж отражает "чистый" тепловой эффект эндотермической реакции, в которой реагенты сначала разогревались внешним источником тепла от 25 до 1500 о С, а в конце реакции продукты опять остывали до комнатной температуры, отдав все тепло в окружающую среду. При этом отданного тепла будет меньше, чем пришлось потратить на разогрев, потому что часть тепла поглотилась в реакции.
Проведем тот же расчет, используя термохимическую шкалу. Допустим, известны теплоты сгорания углерода и железа в кислороде (при неизменном давлении):
1) C + 1/2 O 2 = CO + 110,5 кДж
2) 2 Fe + 3/2 O 2 = Fe 2 O 3 + 822,1 кДж
Чтобы получить тепловой эффект интересующей нас реакции, умножим первое уравнение на 3, а второе перепишем в обратном порядке:
1) 3 C + 3/2 O 2 = 3 CO + 331,5 кДж
2) Fe 2 O 3 + 822,1 кДж = 2 Fe + 3/2 O 2
Теперь почленно сложим оба уравнения:3 C + 3/2 O 2 + Fe 2 O 3 + 822,1 кДж = 3 CO + 331,5 кДж + 2 Fe + 3/2 O 2
После сокращения в обоих частях уравнения кислорода (3/2 O 2) и переноса 822,1 кДж в правую часть получим: 3 C + Fe 2 O 3 = 3 CO + 2 Fe – 490,6 кДж
кинетика химических реакций - раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений Химическая кинетика – наука о скоростях и закономерно-стях протекания химических процессов во времени.
Химическая кинетика изучает механизм протекания процесса, т.е. те промежуточные стадии, состоящие из элементарных актов, через которые система переходит из начального состояния в конечное.
Химическая кинетика изучает скорости этих стадий и факторы, влияющие на их скорость.
Уравнение химической реакции показывает начальное состояние системы (исходные вещества) и её конечное состояние (продукты реакции), но не отражает механизма процесса.
 Аквариум – маленькая искусственная экосистема
Аквариум – маленькая искусственная экосистема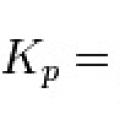 энергия связи – это энергия, необходимая для разрыва химической связи
энергия связи – это энергия, необходимая для разрыва химической связи Галлий где содержится. Применение галлия. Где встречается галлий в природе
Галлий где содержится. Применение галлия. Где встречается галлий в природе